RNA复RNA,RNA何其多,
我生待高纯,万事成蹉跎,
实验苦,提取累,结果总是搞不对。
摸索多次条件提取的RNA,期待它是清晰耀眼无弥散的电泳条带,和理想的OD比值。
提取了这么多次RNA,究竟什么样的RNA是高质量RNA?RNA样品的质量参数达到什么水平能够高枕无忧的应用于下游实验?目前,RNA质量控制由以下三个关键参数组成:
浓度:是否有足够的RNA进行检测?
纯度:RNA是否没有污染物?
完整性:RNA是否降解?
RNA样品的浓度
通常,RNA浓度可通过在分光光度计中测量样品在260nm处的吸光值 (A260) 来确定,吸光度于浓度成正比。中性pH的低盐缓冲液(例如10mM Tris·Cl缓冲液,pH7.0)常用来稀释样品,在此条件下,260nm处的1个单位的吸光值对应于RNA的浓度约为44μg/ml。
RNA浓度和总量测定举例
RNA样品的体积=100µl
按照1体积RNA样品/50体积的缓冲液的比例来稀释即:10µl RNA样品+490µl 10mM Tris•Cl 缓冲液,pH7.0
检测稀释后样本的吸光度,A260=0.3
RNA浓度=44µg/ml x A260 x 稀释系数 = 44µg/ml x 0.3 x 50 = 660µg/ml
RNA总量=浓度 x 样品体积 (ml) = 660µg/ml x 0.1ml = 66µg RNA
RNA样品的纯度
关于A260/A280比值基于分光光度计测得的A260/A280可用于评估RNA的纯度,以及鉴定样品中是否存在蛋白质的污染。然而,A260/A280的比值会显著受到pH值的影响。当使用没有缓冲能力的水时,pH值与A260/A280比值变化都较大。较低的pH值会导致A260/A280的比值变小,对蛋白质污染的敏感性也会随之降低。因此,为了结果的准确性,建议在具有弱碱性的低盐缓冲液(如10mM Tris·Cl,pH7.5)中测量吸光度。在10mM Tris•Cl,pH7.5缓冲液的体系中,当A260/A280比值在1.9–2.1之间,则表示RNA样品纯度较高,更纯的RNA的A260/A280比值应该为2.0左右。当A260/A280<1.9时,样本中可能存在蛋白质污染,常见于酚氯仿法提取的RNA,并通常可能是由于在吸取上清液时吸入了中间层导致的。所以,吸取上清液时宁可少吸一些也不要吸到中间层。另外,一些特殊的组织和植物中,多糖、多酚含量较多,也会导致A260/A280比值偏低。因此,从这类材料中提取RNA时,需要注意多糖、多酚杂质的去除。当A260/A280>2.1时,则代表可能是RNA产生降解而导致的260处吸光值升高。
关于A260/A230比值
纯的RNA A260/A230应该在2左右或者更高一些,然而这个比值的可接受的下限并不明确,包括可导致A260/A230较低的污染物类型也尚未得到完全了解,通常认为可能是由于盐、碳水化合物、多肽和芳香族化合物,如苯酚所造成的[1][2]。在常规的酚氯仿抽提法得到的RNA中,230nm处的吸光度增加大多是由于胍盐类污染,而其主要来源于RNA纯化过程中用到的TRxxxl类裂解液。这类因污染而导致的OD比例异常,不仅会干扰RNA定量的准确性,也会对下游PCR、NGS实验的效率产生极大的干扰,导致假阴性结果的产生。
因此,为了避免RNA样本中的杂质污染而得到高纯度RNA,我们推荐使用RNeasy 系列试剂盒,不仅可以避免异硫氰酸胍、蛋白、基因组DNA等杂质污染,还可为各种样本类型提供专门优化纯化的方法,特别是植物组织、FFPE组织切片、血清或血浆样本、外泌体等难处理样本。关于如何选择试剂盒可点击如下文章查看:如何提好RNA?选择往往比努力更重要!
RNA样品的完整性
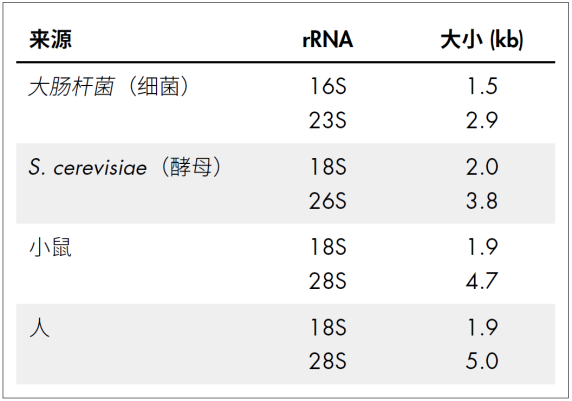
提取RNA后通常采用琼脂糖凝胶电泳来检测RNA样品的完整性,例如完整的人类细胞RNA会在凝胶电泳上产生清晰的28s、18s、5s rRNA条带,而细菌、真菌等其他物种的rRNA大小会有所不同。理论上,28s与18s的例如约为2.7:1,但目前常使用1.8~2:1作为鉴定高质量RNA完整性的标准。如果核糖体的电泳条带不清晰且可见小片段RNA弥散,则意味着RNA样本严重降解。
表1:不同来源的rRNA 的大小
综上所述,传统的测定RNA样本的浓度、纯度和完整性是通过电泳和基于吸光值的测量方法。但这两种方法通常有以下几方面的局限性:
由于RNA很不稳定容易降解,在常规电泳过程中容易发生RNA降解导致形成弥散条带。
DNA和RNA均在260nm波长处有吸收, DNA残留或者RNA残留,都会引起比值的偏差。
RNA浓度低时测量不精准,也会导致A260/A230比值偏低,对核酸的质、量产生误判。
因此,考虑到使用传统的OD比值方法、电泳等方法判断核酸浓度、纯度和完整度的局限性,我们推荐使用来自QIAGEN的QIAxpert洞悉RNA样品的真实质量,并采用QIAxcel Connect实现RNA完整性的客观测定。
QIAxpert洞悉RNA样品真实质量
QIAxpert是创新的高速微流体分光光度计,能够便利地分析样品中的DNA、RNA、蛋白质以及杂质成分。QIAxpert运行速度快、简单易用,可在2分钟内分析16个样本。只需将样品移液至QIAxpert微流体16孔板,插入读取口,并在集成的触屏上选择预存的方法即可。QIAxpert很适合在快节奏的实验室中进行核酸的定量检测和质控。
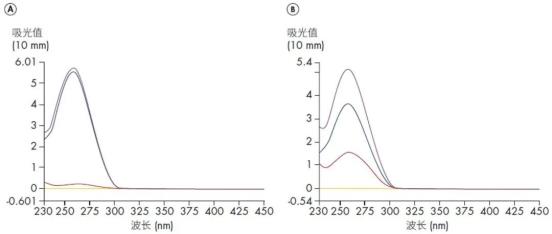 图1. 光谱含量分析(SCP)用于鉴别复杂样品的组分。A. 纯RNA 样本只有一个吸收峰。B. 加入gDNA 的RNA 样本。被准确地分解为代表RNA 蓝色吸收线和代表DNA 的红色吸收线。
图1. 光谱含量分析(SCP)用于鉴别复杂样品的组分。A. 纯RNA 样本只有一个吸收峰。B. 加入gDNA 的RNA 样本。被准确地分解为代表RNA 蓝色吸收线和代表DNA 的红色吸收线。
无论何种缓冲液系统,QIAxpert均能够在一次测量中同时进行产量和纯度评估,不仅可实现DNA、RNA分别定量,还能测量出包括样品浊度、污染核酸、苯酚等污染物情况。数据表明,即使存在硫氰酸胍污染,A260/A230比值很低的情况下也能够实现在50ng/μl RNA样本中的精确定量。
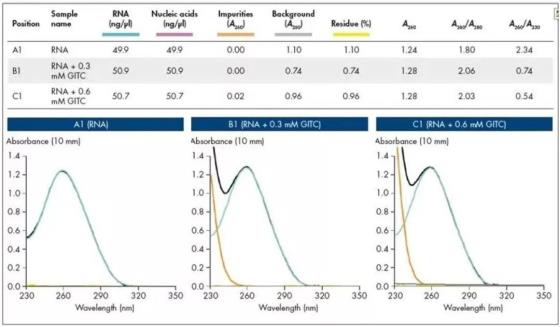 图2. 用QIAxpert进行RNA定量检测。
图2. 用QIAxpert进行RNA定量检测。
QIAxcel Connect实现RNA完整性客观测定
QIAxcel Connect系统是一个多功能的电泳解决方案,具有广泛的应用。预先设定的电泳程序,再加上相应的预制凝胶卡夹,能够分离和分析多种核酸,包括单重/多重PCR片段、DNA 酶切片段、总RNA和cRNA。QIAxcel Connect系统的通量非常适合采用96孔板纯化的RNA样品质控,适用于需要快速质控方案的实验室,以及二代测序实验室文库构建中各步的质量控制。与市场上其他相似仪器不同,QIAxcel Connect系统一次能够处理多达96个样品而无需人工干预。目前有适用于多种应用的多个QIAxcel Connect预置凝胶卡夹,可满足不同的分辨率、灵敏度和速度要求(表2)。
表2:QIAxcel预制凝胶卡夹的规格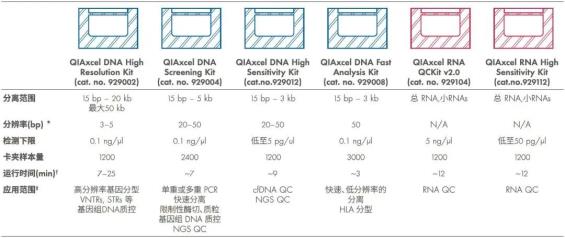
STR: 短串联重复序列;VNTR: 可变数串联重复;* 最佳分辨率在100–500bp;†对应12个样本量;‡包含但不局限
关于RNA的分析,QIAxcel Connect 给出的RNA完整性分数RNA Integrity Score (RIS) 提供了一个客观的RNA样品质量评估,并可以轻松地解析样品的完整性,从而将质量不好的样品剔除,节约时间和经费。RIS从0到10,其中值10表示完全完整的RNA。该系统取代了传统的DNA、RNA凝胶分析,简化实验流程,能够在第一时间获取实验结果。高灵敏的、高分辨率的毛细管电泳完全自动化,采用即用型预置凝胶卡夹,每次运行可自动分析多达96个样品,减少人为操作误差。
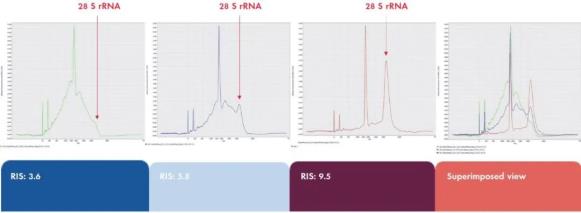 图3. 不同降解程度的 RNA 样品的质控。使用 RNeasy Plus Mini Kit 从小鼠肝脏中进行RNA 提取,后进行热降解。
图3. 不同降解程度的 RNA 样品的质控。使用 RNeasy Plus Mini Kit 从小鼠肝脏中进行RNA 提取,后进行热降解。
参考文献
1.Teare JM, Islam R, FlanaganR, Gallagher S, Davies MG, Grabau C. (1997) Measurement of nucleic acidconcentrations using the DyNA Quant and the GeneQuant. Biotechniques. 6, 1170. www.bcm.edu/mcfweb/?PMID=3100
2.Gallagher SR. Quantitationof DNA and RNA with absorption and fluorescence spectroscopy. (2011) CurrProtoc Mol Biol. 10.1002/0471140864.psa04ks52.
原文地址 https://mp.weixin.qq.com/s/Upd9vMK1pZ1iq0PgxErl5A


